免疫球蛋白Ig由4条多肽链通过链间和链内二硫键连接组成:两条相同的相对分子质量较大的肽链(称为重链,heavychain,H链,相对分子质量约为55000或70000)和两条相同的相对分子质量较小的肽链(称为轻链,light chain,L链,相对分子质量约为24000)组成。让我们把抗体想象成在人的血液里飘浮着的成千上万个双齿的小叉。每个小叉的每个齿都可以黏结一个特定抗原的一个特定部位,这样一个双齿叉可以结合两个同样的抗原。抗原则可以是外来或病变的蛋白,甚至包括入侵病原体(真菌、细菌、病毒等)的RNA、DNA或多聚糖。
用双齿叉打比方只是一个简化的模型。实际上,抗体分子是很有弹性和柔性的,形状也不是明显的“Y”形。在电子显微镜下它看起来更像三个球堆成的“品”字。抗体是比较大的分子,分子量约在150KD左右,是水分子的8千多倍。它宽约4纳米,长约11纳米。如果把一个血小板细胞想象成一个西瓜那么大的话,那一个抗体分子只有西瓜籽那么大。
抗体的结构
1.抗体的类型
抗体重链类型直接决定了抗体的类型,哺乳动物抗体重链可分为五类,分别以希腊字母γ、α、μ、δ、和ε表示,据此将抗体相应地分为IgG、 IgA、 IgM、IgD和IgE。α和γ大约含有450个氨基酸,μ和ε约含550个氨基酸;同时μ链和ε链含有5个肽环,γ链、α链、δ链含有4个肽环。
--IgG是血清中一种主要的Ig,含量占总Ig的65—75%左右。广泛分布于组织液中,血管内、外间隙中分布量大体相当。是机体抗感染的一种重要物质。
--IgM是成熟胎儿合成的第一类Ig,也是在感染或免疫后最早产生的Ig,5类Ig中IgM最强,故其细胞毒活性和细胞溶解活性也最强。天然的血型抗体是IgM,有些自身抗体如抗磷脂抗体、RF等也属于IgM。胎儿脐血中IgM抗体升高,是胎儿遭受感染的标志。
--IgA在血清和组织液中的含量相对较少,血清型IgA含量占总Ig的15—25%,但在外分泌液如初乳、唾液、眼泪、肠道分泌液和支气管分泌液中含量较高。由于IgA主要存在于外分泌液中,故在第一线抗感染防御中起重要作用。
--IgE为单体结构,是正常人血清中含量最少的Ig。IgE在血清和组织液中含量极微,其主要生物学功能是与组织肥大细胞、嗜碱粒细胞表面的特异受体结合。IgE不能激活补体。IgE含量在正常人群波动较大,在特异性过敏反应和寄生虫早期感染患者血清中可升高。当变态反应原与结合在受体上的IgE反应时,可引起肥大细胞、嗜碱粒细胞脱颗粒,释放出组织胺、5—羟色胺等生物活性物质。
--IgD在正常人血清中IgD浓度很低,几乎检测不到。IgD主要存在于人B淋巴细胞表面作为抗原的细胞受体,在血清中IgD含量极微且与膜结合的IgD有不同结构。B细胞上IgD的可变区与该细胞将分泌的IgG、IgA、IgM的可变区相同,当抗原与IgD受体结合时,刺激B细胞繁殖、分化、并分泌对抗原特异的其他类抗体
哺乳动物抗体轻链大约由211–217个氨基酸残基组成,共有两型:kappa(κ)与lambda(λ),同一个天然Ig分子上轻链的类型总是相同。但在同一个体内可存在分别带有κ或λ链的抗体分子。不同种属生物体内两型轻链的比例不同,正常人血清免疫球蛋白κ链:λ链约为2:1,而在小鼠的比例为20:1。其他低等脊椎动物中存在iota (I)亚型轻链,如软骨鱼类和真骨鱼类。
2.抗体的结构
2.1可变区(Variable Region,V区)
抗体小叉与小叉之间在结构上的主要差异是位于齿端的可变区——这些可变区决定着抗体的抗原特异性。H链可变区约含118个氨基酸残基和L链可变区约含108~111个氨基酸残基。可变区是抗体结合抗原的位置,其氨基酸的组成和排列决定抗体的抗原结合特异性。可变区存在一些氨基酸能够高频变化组合的区域,这些区域称为超变区(hypervariable region,HVR),超变区又称为互补决定区(complementarity-determining region, CDR),超变区决定了抗体的独特型(抗独特型抗体表达)。可变区中非HVR部位的氨基酸组成和排列相对比较保守,称为骨架区(framework region,FR区)。VL中的CDR有三个,通常分别位于第24~34,89~97位氨基酸残基,其中CDR3超变程度更高,抗体的特异性和亲和力成熟主要涉及到该区域的改造。
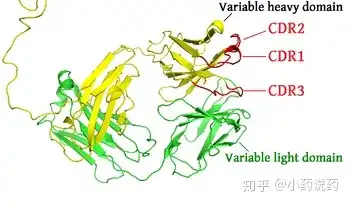
2.2 恒定区(Constant Region, C区)
抗体小叉的柄部由一系列氨基酸序列基本不变的区域组成——我们称之为恒定区。恒定区可以与细胞表面受体或补体系统蛋白相互作用,从而触发宿主效应功能(effector function),比如裂解入侵细胞或吞噬外来病原。抗体恒定区域位于H链靠近C端的3/4或4/5(约从119位氨基酸至C末端) 和L链靠近C端的1/2(约含105个氨基酸残基)区域。抗体重链恒定区分为CH1,CH2和CH3,其中CH3区域涉及到细胞膜表面受体结合,CH2涉及补体激活途径,是补体结合位点。简单来说,叉齿负责识别抗原,而叉柄则帮助宿主决定如何处置抗原。
2.3 抗体Fab段和Fc段
IgG经木瓜蛋白酶酶切后裂解为2个完全相同的Fab段和1个Fc段,每个Fab段都为单价,可与抗原结合但不会再发生凝集反应;经胃蛋白酶酶切后裂解为1个完整F(ab)2片段和碎片化的Fc片段,F(ab’)2片段为双价,可同时结合两个抗原表位。Fab段为抗原结合片段(fragment of antigen binding,Fab),相当于抗体分子的两个臂,由一个完整的轻链和重链的VH和CH1结构域组成。Fc段为可结晶段(fragmentcrystallizable,Fc)相当于Ig的CH2和CH3结构域,是Ig与效应分子或者细胞相互作用的部位。Fab段包含完整的可变区,以及恒定区的CH1区域。Fc段仅指Ig恒定区CH2和CH3的区域,相当于Y字结构下面那一部分。
2.4重链抗体的结构
骆驼类和软骨鱼类中天然缺失轻链的抗体又被称为重链抗体,存在于亚洲的西亚骆驼(Camelusbactrianus)、非洲的单峰驼(C.dromedarius)和南美的大羊驼(Lama glama)、原驼(L.guanicoe)、羊驼(Vicugna pacos)和小羊驼(V.vicugna)等骆驼科中。
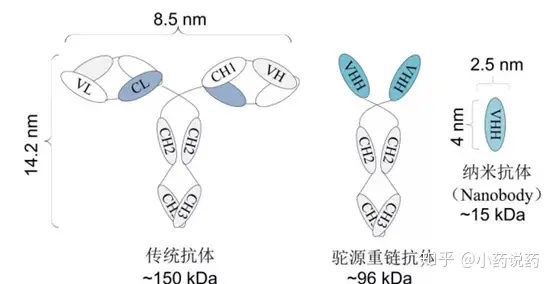
1995年又在护士鲨(Ginglymostoma cirratum)、斑纹须鲨(Oretolobus maculatus)、银鲛等软骨鱼中发现了无轻链或其他蛋白分子伴随的类似于重链抗体的抗原受体(new or nurse shark antigen receptor,NAR)。由于NAR分子与Ig亚型在跨膜和分泌方式等几个功能特征方面近似,因此也被称为免疫球蛋白新抗原受体(Ig new antigen receptor,IgNAR)。重链抗体具有广泛应用价值的是单域重链抗体(single domainantibody,sdAb)部分。单域重链抗体是指仅由重链抗体可变区(Variable region)组成的基因工程抗体,又称为VHH抗体(variable domain of heavy chain of heavy-chain antibody,VHH antibody)或纳米抗体(Nanobody,Nb),分子量为12-15 kD。
|